Bioquímica
Transfiriendo la eficacia sintética de la Naturaleza al laboratorio
“...I can forsee a time in which physiological chemistry will not only make grater use of natural enzymes but will actually resort to creating synthetic ones”.
Emil Fischer, Nobel Lecture, 1902
La Naturaleza ha sido desde siempre una permanente fuente de inspiración para los químicos, no sólo por la gran diversidad de compuestos que los seres vivos son capaces de crear sino también por las extraordinarias estrategias sintéticas empleadas para ello. La miríada de reacciones químicas que tienen lugar en un ser vivo para construir complejas estructuras a partir de elementos sencillos, obtener y almacenar energía y conocer y comunicarse con su entorno, son posibles gracias a la existencia de las enzimas. Las enzimas son proteínas que actúan como catalizadores (sustancias que, sin consumirse en una reacción, aumentan notablemente su velocidad) que presentan unas extraordinarias características en cuanto a la eficacia y especificidad con la que pueden procesar una reacción.
Sin embargo, para aprovechar plenamente la extraordinaria capacidad que presentan las enzimas para construir nuevas moléculas, los seres vivos aplican una serie de estrategias sintéticas tremendamente ingeniosas. En general, los seres vivos no utilizan las enzimas aisladamente sino que las emplean en reacciones multi-pasos (rutas biosintéticas) catalizadas por enzimas que actúan de forma secuencial. La acción concertada de varias enzimas permite convertir en irreversible un proceso reversible, eliminar problemas de inhibición por exceso de producto o de prevenir la falta de sustratos por su dilución o degradación en el medio celular, etc. Durante la evolución, algunos de estas rutas multi-enzimáticas han sido optimizadas uniendo dos o más enzimas en una única proteína dando lugar a la aparición de enzimas multifuncionales o de complejos enzimáticos. El objetivo último de la biocatálisis es transferir la exquisita eficacia que muestran las enzimas en la naturaleza al laboratorio. Para ello, la Biocatálisis debe no solo utilizar las enzimas como catalizadores, sino imitar las estrategias sintéticas empleadas por la Naturaleza. Este objetivo empieza a hacerse realidad a partir de finales de la década de los 80 del siglo pasado con la invención de la Reacción en Cadena de la Polimerasa (PCR en sus siglas en inglés). Esta reacción —que recibió el premio Nobel de Química el año 1992— permite amplificar un fragmento determinado de DNA millones de veces.
El desarrollo de la PCR ha permitido que el número de enzimas disponibles se haya incrementado exponencialmente. Esto nos ha permitido asimilar las rutas biosintéticas desarrolladas por los seres vivos a la utilización de sistemas multi-enzimáticos. Se ha hecho realidad la posibilidad de modificar las propiedades de especificidad, duración, resistencia a la temperatura, etc. de las enzimas para adaptarlas al nuevo entorno que supone el tubo de ensayo. Hemos aprendido a imitar las estrategias que emplea la Naturaleza para crear nuevas enzimas y adaptar las existentes a nuevas necesidades sintéticas. Podemos crear enzimas multifuncionales mediante la unión de genes que codifican para distintas enzimas y evolucionar una enzima en el laboratorio acelerando un proceso que en la naturaleza tardarían miles de años. La inmovilización enzimática en soportes sólidos permite la compartimentalización de enzimas que requieran condiciones de reacción que sean incompatibles entre sí imitando la compartimentalización que se produce en los distintos orgánulos celulares.
Por fin el vaticinio de Emil Fisher se ha hecho realidad.
Eduardo García-Junceda (Instituto de Química Orgánica General, CSIC)
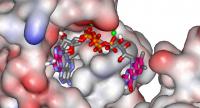
Según el Diccionario de la Real Academia Española de la Lengua la palabra promiscuidad tiene dos acepciones: mezcla, confusión es la primera acepción, mientras que la segunda es convivencia con personas de distinto sexo. Sin embargo, el término promiscuidad aplicado a las enzimas (moléculas de naturaleza proteica que permiten acelerar reacciones químicas o hacen posibles aquellas que no se producirían en su ausencia) lo podemos definir como la capacidad de una enzima de realizar dos reacciones distintas. Pero, ¿qué tiene que ver la promiscuidad enzimática con la evolución? Los seres vivos a lo largo de la evolución modifican la actividad de las enzimas que poseen o crean nuevas actividades enzimáticas que les permitan producir nuevas moléculas y estructuras, utilizar diferentes fuentes de energía o colonizar nuevos hábitats. Sin embargo, mientras se desarrolla el proceso evolutivo cada individuo concreto tiene que seguir viviendo en el hábitat para el que está adaptado y por lo tanto necesita sus enzimas originales. ¿Cómo se soluciona esta aparente paradoja? ¿Cómo obtener una nueva enzima sin perder la original? Uno de los principales mecanismos por los que se puede crear una nueva función es la duplicación génica. La duplicación de un gen determinado (en este contexto entendemos por gen un fragmento de DNA que codifica para una enzima) implica que van a existir dos copias de la misma enzima y por lo tanto va a ser posible que una de las copias del gen duplicado acumule mutaciones que en algún caso pueda proporcionar al organismo una nueva actividad enzimática que le proporcione alguna ventaja y por lo tanto se conserven durante la evolución. En este sentido, la promiscuidad enzimática puede ser un mecanismo alternativo para la obtención de nuevas actividades enzimáticas de forma previa a la duplicación génica.
En un reciente trabajo, investigadores del Instituto de Química Orgánica General (IQOG), han capturado una foto fija de la evolución de una enzima promiscua, en la que mientras se mantiene la función original, la nueva actividad está evolucionando sin necesidad de duplicación génica. En el trabajo se describe el comportamiento promiscuo de la enzima dihidroxiacetona quinasa (DHAK) de la bacteria Citrobacter freundii. La función generalmente aceptada de esta enzima es la de fosforilar la dihidroxiacetona a dihidroxiacetona fosfato (DHAP) usando adenosín trifosfato (ATP, del inglés Adenosine TriPhosphate) (principal fuente de energía de los seres vivos); la DHAP se utiliza en la biosíntesis de lípidos y carbohidratos. Los autores describen que la DHAK posee una actividad adicional (ciclasa), por la cual es capaz de ciclar la molécula de flavín adenín dinucleótido (el FAD es una coenzima que interviene como dador o aceptor de electrones y protones en reacciones metabólicas de oxidación y reducción) dando lugar a riboflavina 4’,5’-fosfato y adenosín monofosfato (AMP, del inglés Adenosine MonoPhosphate). Un aspecto fundamental de este trabajo es que los autores no describen simplemente el comportamiento promiscuo de una enzima sino que proponen un mecanismo que permite mantener ambas actividades en ausencia de duplicación génica y proporciona una explicación de cómo la promiscuidad catalítica de una enzima actúa como punto de arranque para su evolución Darwiniana, adquiriendo una nueva función sin perder la original y por lo tanto manteniendo la eficacia (“fitness”) del organismo a lo largo del proceso evolutivo. El comportamiento promiscuo de esta enzima está controlado y modulado por el catión divalente (Mg2+ o Mn2+) que forma el complejo con el sustrato fosforilado (ATP o FAD). Mientras que la actividad quinasa es prácticamente independiente del catión divalente, la actividad ciclasa aumenta 50 veces cuando se emplea Mn2+ como cofactor. Además, cuando el Mn2+ supera cierta concentración la actividad quinasa es inhibida. Es decir, la concentración de Mn2+ actúa como un interruptor que apaga la actividad principal al encender la actividad promiscua o secundaria. Este mecanismo permite explicar cómo se pueden mantener dos actividades en una misma enzima.
Este trabajo ha sido publicado en la revista ChemBioChem y ha sido comentado en la sección “Editor’s Choice” de Science (2009, 323, 438).
Publicación
I. Sánchez-Moreno, L. Iturrate, R. Martín-Hoyos, M. L. Jimeno, M. Mena, A. Bastida y E. García-Junceda. From Kinase to Cyclase: An Unusual Example of Catalytic Promiscuity Modulated by Metal Switching. ChemBioChem. (2009), 10, 225-229
Grupo de trabajo de investigación de Eduardo García-Junceda (Instituto de Química Orgánica General, CSIC)